Análisis de riesgos en la producción de los juegos de reactivos liofilizados de anticuerpos monoclonales para la marcación con tecnecio-99m
Contenido principal del artículo
Resumen
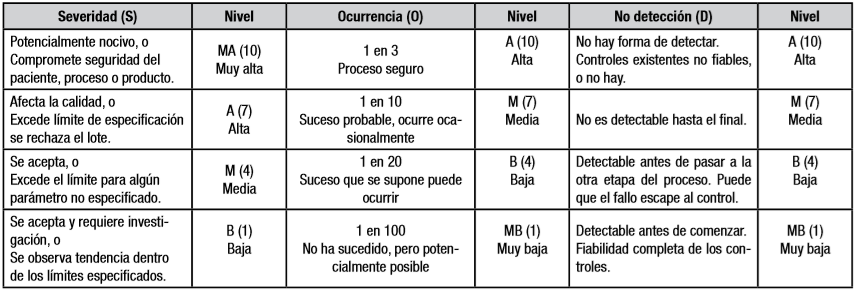
La obtención de la Licencia Sanitaria de Operaciones Farmacéuticas impone contar con el análisis de riesgos a la calidad en el proceso de fabricación de cada producto. El objetivo del presente trabajo fue aplicar esta evaluación al proceso de producción de inyectables liofilizados de anticuerpos monoclonales, que se desarrollan en el Centro de Isótopos, para la marcación con Tecnecio-99m. Se emplearon la técnica de análisis de modos y efectos de fallo, y el código cubano SECURE-MR-FMEA versión 3.0. El levantamiento de los subprocesos, etapas y modos de fallo se realizó mediante tormenta de ideas. Un panel de expertos concilió sus resultados y determinó las causas básicas más influyentes. El modelo consta de diez subprocesos, 28 etapas y 40 modos de fallo. De las 98 posibles, se identificaron 39 combinaciones de Subproceso-Etapa-Modo de fallo-Causa, con número de prioridad de riesgo (NPR)≥100 e índice de severidad (ISev)≥7. Los subprocesos más contribuyentes fueron: la fabricación, el acondicionamiento e higienización del área limpia, la preparación de cristalería y materiales y la obtención del agua para inyección. Las causas básicas más importantes fueron: la capacitación y el entrenamiento del personal; el incumplimiento de prácticas, protocolos, procedimientos o normas; y el empleo de equipos calificados. Los resultados del análisis de sensibilidad realizado mostraron que, con la solución de estas causas, se logra reducir de forma significativa los riesgos del proceso y contribuir así, el cumplimiento de las buenas prácticas de producción, con la prioridad de las acciones y recursos en estas direcciones.
Detalles del artículo

Esta obra está bajo licencia internacional Creative Commons Reconocimiento-NoComercial 4.0.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
- Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0) que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación esta revista. Bajo esta licencia el autor será libre de:
- Compartir — copiar y redistribuir el material en cualquier medio o formato
- Adaptar — remezclar, transformar y crear a partir del material
- El licenciador no puede revocar estas libertades mientras cumpla con los términos de la licencia
Bajo las siguientes condiciones:
- Reconocimiento — Debe reconocer adecuadamente la autoría, proporcionar un enlace a la licencia e indicar si se han realizado cambios. Puede hacerlo de cualquier manera razonable, pero no de una manera que sugiera que tiene el apoyo del licenciador o lo recibe por el uso que hace.
- NoComercial — No puede utilizar el material para una finalidad comercial.
- No hay restricciones adicionales — No puede aplicar términos legales o medidas tecnológicas que legalmente restrinjan realizar aquello que la licencia permite.
- Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
- Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).
La Revista Nucleus solo aceptará contribuciones que no hayan sido previamente publicados y/o procesados, por otra publicación. Cualquier violación ese sentido será considerada una falta grave por parte del autor principal lo cual será objeto valoración por parte del Consejo Editorial, el cual dictaminará al respecto.
Citas
[2]. PEÑA Y, PERERA A, BATISTA JF. Immunoscintigraphy and Radioimmunotherapy in Cuba: Experiences with Labeled Monoclonal Antibodies for Cancer Diagnosis and Treatment (1993-2013). MEDICC Review. 2014; 16 (3-4): 55-60.
[3]. Centro para el Control Estatal de Equipos y Medicamentos (CECMED). Resolución CECMED No. 155/2012. Aprueba la Guía de administración de riesgos a la calidad.
[4]. OJEDA Y, HEYNNGNEZZ L, GARCÍA J, VALDÉS Y, et. al. Aplicación del análisis de riesgo en la preparación de soluciones para producción de Quimi-Hib®. VacciMonitor. 2013; 22(2): 19-23. Disponible en: www.finlay.sld.cu/vaccimonitor.htm.
[5]. Oficina Nacional de Normalización. Sistemas de Gestión de la Calidad. Requisitos. NC ISO 9001. La Habana, 2015. [consulta: 10/10/2019]. Disponible en: http://www.nc.cubaindustria.cu.
[6]. Oficina Nacional de Normalización. Gestión del riesgo-principios y directrices. NC-ISO 31000, 2019. [consulta: 10/10/2019]. Disponible en: http://www.nc.cubaindustria.cu.
[7]. TORRES VALLE A. Programa de análisis de riesgo basado en matriz de riesgo y FMEA. Manual de Usuario SECURE-MR-FMEA 3.0. La Habana, 2017.
[8]. GARCÍA J, SANTANA Z, ZUMALACÁRREGUI L, QUINTANA M, et. al. Aplicación del análisis de riesgo a la producción de proteínas recombinantes expresadas en Escherichia coli. VacciMonitor. 2012; 21(2): 35-42. Disponible en: www.finlay.sld.cu/vaccimonitor.htm.
[9]. AMADOR BALBONA Z, TORRES VALLE A. Causas básicas de fallos aplicadas al análisis de riesgo en práctica médicas con radiaciones ionizantes [Internet]. Revista Cubana de Salud y Trabajo 20(2):11-8 2019 [consulta: 03/11/2019]. Disponible en: http://www.revsaludtrabajo.sld.cu/index.php/revsyt/article/view/99.
[10]. Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED). Buenas prácticas farmacéuticas. Sistema regulador en Cuba. Segunda edición. La Habana: CECMED, 2017.
[11]. GUTIÉRREZ PULIDO H. Calidad total y productividad. México. 3era Edición. McGraw-Hill/Interamericana Editores, S.A. de C.V., 2010.
[12]. DA SILVA TEIXEIRA F, DE ALMEIDA C, SAIFUL HUQ M. Failure mode and effect analysis based risk profile assessment for stereotactic radiosurgery programs at three cancer centers in Brazil. Medical Physics. 2016; 43(1): 171-8.
[13]. ROY S, RUITBERG C, SETHURAMAN A. Troubleshooting During the Manufacture of Lyophilized Drug Product- Being Prepared for the Unexpected [Internet]. [consulta: 04/02/2021]. Disponible en: www.americanpharmaceuticalreview.com/Featured-Articles/126958.
[14]. Assure Batch Uniformity for Freeze-Dried Products. [Internet]. [consulta: 04/02/2021]. Disponible en: https://www.pharmamanufacturing.com/articles/2005/191.
[15]. SALAZAR MACIAN R. Problemas tecnológicos en la fabricación de medicamentos. Apuntes sobre tecnología farmacéutica. Barcelona, 2015. [consulta: 05/03/2021]. Disponible en: http://hdl.handle.net/2445/68462.
[16]. COOKE D, DUBETZ M, HESHMATI R, IFTODY S, et. al. A reference guide for learning from incidents in radiation treatment. Alberta Heritage Foundation for Medical Research, 2006.