Producción de [18F]Fludesoxiglucosa en Cuba
Contenido principal del artículo
Resumen
Con la implementación de la tecnología en Cuba para la fabricación de [18F]Fludesoxiglucosa ([18F]FDG), se incursiona por primera vez en el país en la producción de radiofármacos positrónicos marcados con un radionucleido obtenido en ciclotrón.
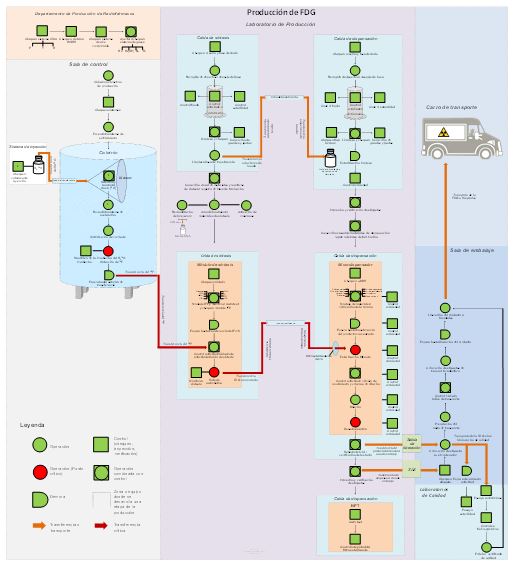
Este trabajo presenta el diseño del flujo productivo para la fabricación de [18F]FDG en el Centro Especializado de Diagnóstico y Terapia teniendo en cuenta las directrices establecidas por las Buenas Prácticas de Fabricación y las Normas Básicas de Seguridad Radiológica. Además, se muestra la evaluación de consistencia en lotes de producción, información que complementó la validación de proceso. Como resultado se obtuvo que el proceso productivo, según el flujo diseñado, es capaz de brindar consistentemente un producto farmacéutico inyectable de la calidad requerida y que cumple con sus especificaciones.
Detalles del artículo

Esta obra está bajo licencia internacional Creative Commons Reconocimiento-NoComercial 4.0.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
- Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0) que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación esta revista. Bajo esta licencia el autor será libre de:
- Compartir — copiar y redistribuir el material en cualquier medio o formato
- Adaptar — remezclar, transformar y crear a partir del material
- El licenciador no puede revocar estas libertades mientras cumpla con los términos de la licencia
Bajo las siguientes condiciones:
- Reconocimiento — Debe reconocer adecuadamente la autoría, proporcionar un enlace a la licencia e indicar si se han realizado cambios. Puede hacerlo de cualquier manera razonable, pero no de una manera que sugiera que tiene el apoyo del licenciador o lo recibe por el uso que hace.
- NoComercial — No puede utilizar el material para una finalidad comercial.
- No hay restricciones adicionales — No puede aplicar términos legales o medidas tecnológicas que legalmente restrinjan realizar aquello que la licencia permite.
- Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
- Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).
La Revista Nucleus solo aceptará contribuciones que no hayan sido previamente publicados y/o procesados, por otra publicación. Cualquier violación ese sentido será considerada una falta grave por parte del autor principal lo cual será objeto valoración por parte del Consejo Editorial, el cual dictaminará al respecto.
Citas
[2] Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED). Buenas Prácticas de Producción de Radiofármacos. Regulación No. 16-2012. Anexo no. 05. CECMED, 2014.
[3] Pharmaceutical inspection convention- Pharmaceutical inspection co-operation scheme. Guide to good manufacturing practice for medicinal products. Annexes. Geneva: PIC/S Secretariat, 2017.
[4] United States Pharmacopeia (USP). Farmacopea de los Estados Unidos de América. Cap 823. USP 40 NF35 ed. Vol. 1. 817-828.
[5] International Atomic Energy Agency (IAEA). Cyclotron produced radionuclides: guidance on facility design and production of fluorodeoxyglucose (FDG). Vienna: IAEA, 2012.
[6] Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED). Regulación no. 16-2012 Directrices sobre Buenas Prácticas de Fabricación de productos farmacéuticos. CECMED, 2012.
[7] QUIRÓS AR. Radiofármaco [18F]FDG un aporte novedoso para el diagnóstico de cáncer en el país. Revista Médica de la Universidad de Costa Rica. 2015; 9(2). Disponible en: https://revistas.ucr.ac.cr/index.php/medica/article/view/22002/22184.
[8] YU S. Review of 18F-FDG synthesis and quality control. Biomed Imaging Interv J. 2006; 2(4): e57.
[9] SCHUBIGER PA, LEHMANN L, FRIEBE M. PET chemistry the driving force in molecular imaging. J Nucl Med. 2007; 48(10): 1750.
[10] United States Pharmacopeia (USP). Farmacopea de los Estados Unidos de América. Monografía Fludesoxiglucosa F 18, Inyección. USP 40 NF-35 ed. Vol. 2. 4673.
[11] LOVELESS VS. Quality control of compounded radiopharmaceuticals. The University of New Mexico Health Sciences Center, 2009. Disponible en: https://pharmacyce.unm.edu/nuclear_program/freelessonfiles/vol15lesson3.pdf.