Aporte de la corrección de dispersión por Tomografía para la estimación de actividad en estudios híbridos del tiroides con 131I
Contenido principal del artículo
Resumen
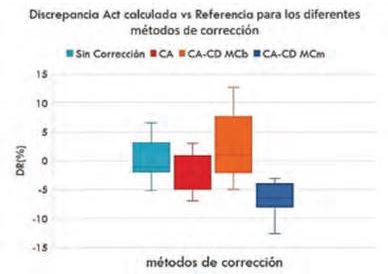
El hipertiroidismo es uno de los tratamientos más frecuentes de MN, sin embargo la cuantificación de la actividad del empleando técnicas Tomografía por Emisión de Fotón Único (SPECT) y combinadas con Tomografía Computarizada (SPECT/CT) no tiene antecedentes bibliográficos amplios. Este trabajo estudió el impacto de las correcciones de dispersión por CT en la cuantificación de la actividad de 131I en la tiroides. Se emplearon para la calibración 3 fuentes de actividad conocida (1.06 MBq ,2.61 MBq y 4.66 MBq) con incertidumbre típica del 2.4 % y el maniquí clásico de tiroides. Se calcularon los factores de calibración y su incertidumbre para cada caso. Para analizar la exactitud del sistema se estimaron las actividades de un conjunto de 11 fuentes (1.37 MBq-3.92 MBq) y la incertidumbre en cada caso. Se compararon las discrepancias entre la actividad calculada versus referencia por los diferentes métodos de corrección de dispersión por CT que provee el equipo (valor de significación estadística p<0.05). La menor discrepancia promedio encontrada fue de 3 % (de -5 a 7 %), sin corrección alguna. Las incertidumbres se encontraron en el rango de 9 a 11 %, siendo consistentes con las discrepancias halladas. Conclusiones: Las correcciones de atenuación y dispersión por Monte Carlo empleando CT no mejoraron la exactitud de la cuantificación de actividad en la geometría clásica del maniquí, aunque se recomienda ampliar el rango de masas del tiroides para representar mejor la situación clínica paciente específica y confirmar estos resultados.
Detalles del artículo

Esta obra está bajo licencia internacional Creative Commons Reconocimiento-NoComercial 4.0.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
- Los autores/as conservarán sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia Creative Commons Attribution-NonCommercial 4.0 International (CC BY-NC 4.0) que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación esta revista. Bajo esta licencia el autor será libre de:
- Compartir — copiar y redistribuir el material en cualquier medio o formato
- Adaptar — remezclar, transformar y crear a partir del material
- El licenciador no puede revocar estas libertades mientras cumpla con los términos de la licencia
Bajo las siguientes condiciones:
- Reconocimiento — Debe reconocer adecuadamente la autoría, proporcionar un enlace a la licencia e indicar si se han realizado cambios. Puede hacerlo de cualquier manera razonable, pero no de una manera que sugiera que tiene el apoyo del licenciador o lo recibe por el uso que hace.
- NoComercial — No puede utilizar el material para una finalidad comercial.
- No hay restricciones adicionales — No puede aplicar términos legales o medidas tecnológicas que legalmente restrinjan realizar aquello que la licencia permite.
- Los autores/as podrán adoptar otros acuerdos de licencia no exclusiva de distribución de la versión de la obra publicada (p. ej.: depositarla en un archivo telemático institucional o publicarla en un volumen monográfico) siempre que se indique la publicación inicial en esta revista.
- Se permite y recomienda a los autores/as difundir su obra a través de Internet (p. ej.: en archivos telemáticos institucionales o en su página web) antes y durante el proceso de envío, lo cual puede producir intercambios interesantes y aumentar las citas de la obra publicada. (Véase El efecto del acceso abierto).
La Revista Nucleus solo aceptará contribuciones que no hayan sido previamente publicados y/o procesados, por otra publicación. Cualquier violación ese sentido será considerada una falta grave por parte del autor principal lo cual será objeto valoración por parte del Consejo Editorial, el cual dictaminará al respecto.
Citas
[2]. CHAI T & DRAXLER RR. Root mean square error (RMSE) or mean absolute error (MAE)? Arguments against avoiding RMSE in the literatura. Geoscientific Model Development. 2014; 7(3): 1247-1250.
[3]. PÉREZ MM. Estimación de incertidumbres. Guía GUM. Revista Española de Metrología 2012; diciembre: 113-130.
[4]. CAYIR D & ARAZ M. Radioiodine therapy of benign thyroid diseases. International Journal of Nuclear Medicine Research. 2017; 4: 6-12.
[5]. VIJA RACARU L, FONTAN C, BAURIAUD-MALLET M, et. al. Clinical outcomes 1 year after empiric 131I therapy for hyperthyroid disorders: real life experience and predictive factors of functional response. Nucl Med Commun. 2017; 38(1): 756-763.
[6]. RAMOS E, LÓPEZ A, and PÉREZ A. Implementation of “S factor methods” for 3D dose planning in 131I hyperthyroidism treatment. XV Workshop on Nuclear Physics and IX International Symposium on Nuclear and Related Techniques (WONP-NURT). 2017. Havana, Cuba.
[7]. LÓPEZ A. Dosificación del tratamiento con I-131 en Hipertiroidismo mediante técnicas paciente-específicas [tesis para optar por título de doctor]. La Habana: InSTEC, diciembre 2018.
[8]. RITT P, et. al. Absolute quantification in SPECT. Eur J Nucl Med Mol Imaging. 2011; 38 Suppl 1: S69-77.
[9]. BRILL A, et. al. Normal Organ Radiation dosimetry and associated uncertainties in nuclear medicine, with emphasis on Iodine-131. Radiat Res. 2006; 166(1 Pt 2): 128-140.
[10]. LI T, et. al. Quantitative Imaging for Targeted Radionuclide Therapy Dosimetry - Technical Review. Theranostics. 2017; 7(18): p. 4551-4565.
[11]. DEWARAJA Y, KORAL K & FESSLER J. Quantitative I-131 SPECT reconstruction using CT side information from hybrid imaging. 2009 IEEE Nuclear Science Symposium Conference Record (NSS/MIC). 2009. pp. 2523-2529. doi: 10.1109/NSSMIC.2009.5402033.
[12]. PEREIRA J, et. al. Image quantification for radiation dose calculations - limitations and uncertainties. Health Phys. 2010; 99(5): 688-701.
[13]. HE B & FREY EC. The impact of 3D volume of interest definition on accuracy and precision of activity estimation in quantitative SPECT and planar processing methods. Phys Med Biol. 2010; 55(12): 3535-44.
[14]. DEWARAJA Y, et. al. MIRD Pamphlet No. 23: Quantitative SPECT for patient-specific 3-dimensional dosimetry in internal radionuclide therapy. J Nucl Med. 2012; 53(8): 1310-25.
[15]. RITT P, et. al. Absolute quantification in SPECT. Eur J Nucl Med Mol Imaging. 2011; 38 Suppl 1: S69-77.
[16]. Institute of Physics & Engineering In Medicine (IPEM). Report 104 Dosimetry for Radionuclide Therapy. IPEM Report Series, 2011.
[17]. DEWARAJA Y, et. al. Accurate dosimetry in I-131 radionuclide therapy using patient-specific, 3-dimensional methods for SPECT reconstruction and absorbed dose calculation. J Nucl Med. 2005; 46(5): 840-849.
[18]. BRILL A, et. al. Normal organ radiation dosimetry and associated uncertainties in nuclear medicine, with emphasis on iodine-131. Radiat Res. 2006; 166(1 Pt 2): 128-40.
[19]. DEWARAJA Y, KORAL K & FESSLER J. Quantitative I-131 SPECT Reconstruction using CT Side Information from Hybrid Imaging. 2009 IEEE Nuclear Science Symposium Conference Record (NSS/MIC). 2009. pp. 2523-2529. doi: 10.1109/NSSMIC.2009.5402033.
[20]. PEREIRA J, et. al. Image quantification for radiation dose calculations - limitations and uncertainties. Health Phys. 2010; 99(5): 688-701.